多组学整合方案研究服务 - 蛋白质组&GWAS联合研究
伴随生物组学调控理论体系的日益完善,以及组学检测技术的高速发展,”Multi-omics”多组学联合研究已经成为复杂表型分子机制研究的重要手段,相对于单一组学的研究策略,可以开展多维度组学交互调控网络构建、协同调控机制分析、多标记物预测模型优化等更为全面、更具深度的分子病因学研究,进而精准筛选与表型组有关的重要生物学通路以及关键的调控分子,为疾病发生、新药研发等提供殷实的组学大数据支持。
不同组学以及不同的调控元件,由于其生物学意义及调控机制的差异,需要综合待研究疾病表型的病理特征、科研目标、流行病学特点、队列样本类型等等因素考量,从而制定最佳的方法学研究路线。根据系统生物学的组学特点,以SNP遗传标记物为核心的GWAS研究,属于队列样本基因组遗传研究的最重要策略,在多组学研究体系中发挥遗传基线数据的作用,对于其他所有组学变化均存在潜在的“起因”调控,在不同组学层面QTL关联分析的基础上,开展network体系构建,成为Multi-omics研究的经典研究路线,科研成果丰硕;蛋白质组学作为发挥生物活性的最小载体,其蛋白质种类、丰度及活性,对于系统生物学及表型组发挥至关重要的功能作用,成为多组学功能研究的必要验证性数据;代谢组学作为宿主系统生物学的结局,是生物功能调控反应的最终产物,也是最接近外在表型的生物小分子组学,成为完整调控网络以及预测模型构建的成熟研究领域,此外也作为微生物组学与宿主调控的关键中介分子等等。
在上述多组学研究体系中,围绕GWAS、代谢组、蛋白质组的联合研究,由于系统的中心法则理论体系、成熟的检测技术、完善的数据分析方法等因素,成为多组学领域中应用最为广泛的策略之一。从目前该方向的研究动态分析,主要包括三个方面的重要科研意义:(1)针对特定人群(自然人群、特定疾病人群等)开展mQTL、pQTL的联合分析及构建network调控网络,筛选关键的遗传调控通路与表型的生物机制关系;(2)针对case/control的横断面队列样本,围绕发现的关键差异代谢物,通过GWAS数据的工具变量特性,采用孟德尔随机化(Mendelian Randomization,MR)分析策略,从而推断显著代谢物、蛋白质与疾病表型(结局)的因果关系;(3)通过多维度组学的标记物筛选,联合PRS遗传风险评估分值及显著代谢物、蛋白质,从生物分子层面构建疾病早期预警模型。
Proteomics&GWAS approach研究策略—研究路径概述:
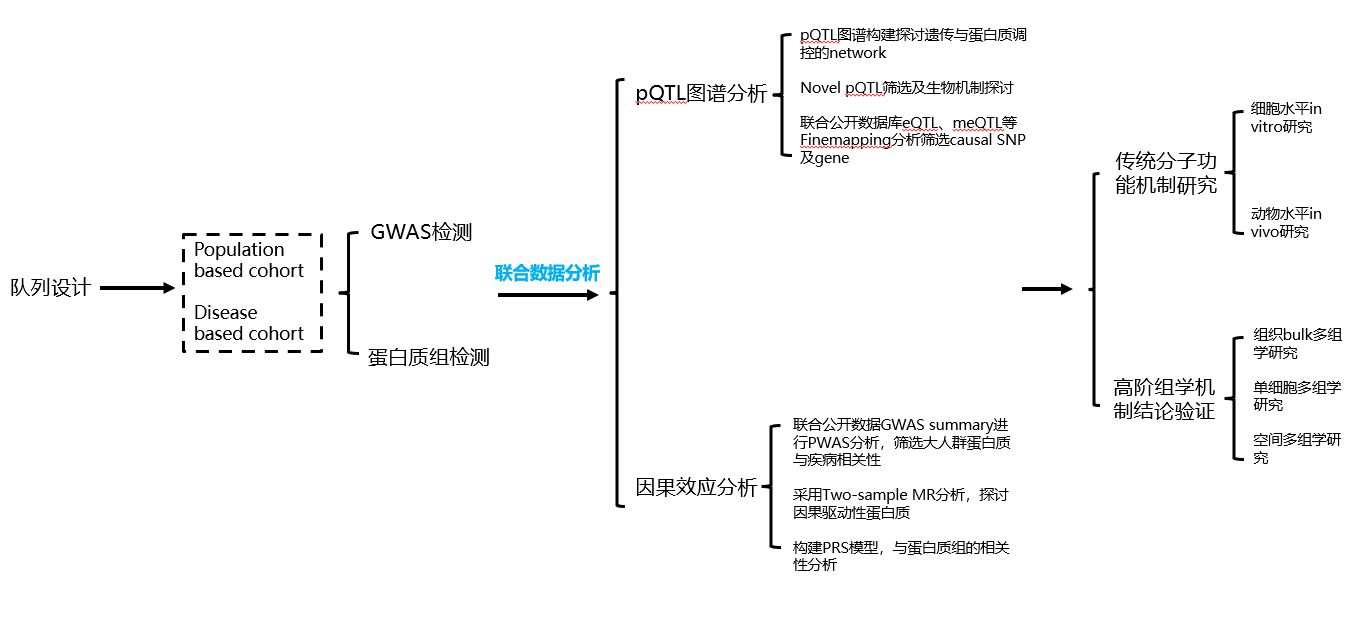
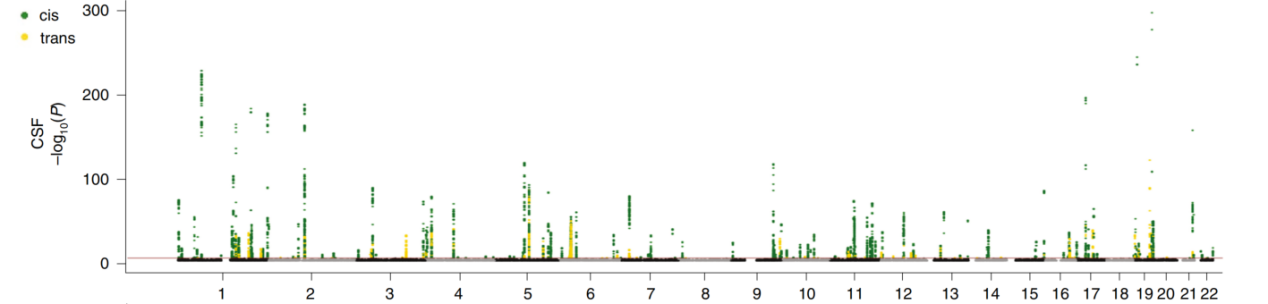
pQTL图谱分析:
通过蛋白定量数据与GWAS进行关联分析,根据SNP位点与蛋白的基因组位置关系,筛选显著差异的cis-及trans-的pQTL,并呈现完整的pQTL统计结论图谱。示例如下:
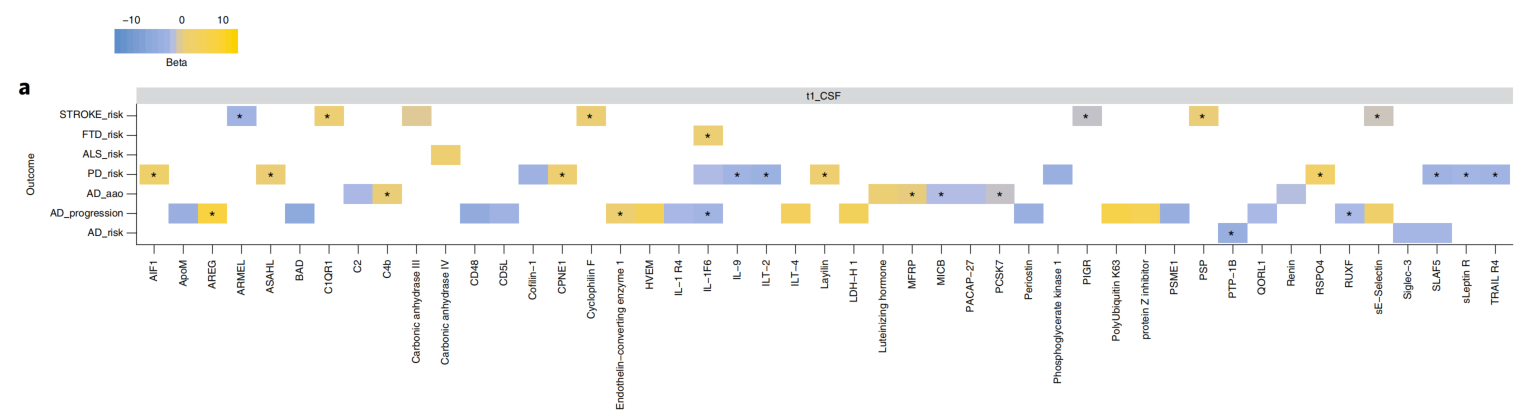
MR随机化因果推断分析:
以GWAS数据作为工具变量,开展不同组学与表型结局、不同暴露因素与表型结局、不同表型结局之间的MR随机化因果推断分析,已经成为近年来分子流行病学研究的重要分析手段,相关的MR算法层出不穷,日益完善,为该领域的统计分析性结论提供了强有力的算法支撑。目前有很多文章报道,通过MR随机化分析获得的分子标记物与疾病发生的因果关系,在真实世界观察性研究中均得到了证实,再次说明了MR因果分析的必要性和重要性。分析示例如下: